Dynamique des interactions cellules souches / niches
Thèmatique de recherche
La pérennité de l'hématopoïèse est assurée grâce aux propriétés de multipotence, de quiescence, d'auto-renouvellement/prolifération et de différenciation des cellules souches hématopoïétiques (CSH). Ces différentes propriétés sont finement régulées par des mécanismes intrinsèques mais également par des mécanismes extrinsèques faisant intervenir des interactions avec des microenvironnements spécialisés situés au sein de la moelle osseuse chez l'adulte, appelés « niches ». Depuis l'émergence du concept de niche à cellules souches par Schofield en 1978 chez la souris, deux types de niches ont été décrites au sein de la moelle osseuse : les niches endostéales et vasculaires. Bien que leurs rôles respectifs soient toujours l'objet de nombreuses controverses, il est actuellement accepté que les niches endostéales, principalement constituées par les ostéoblastes d'origine mésenchymateuses et les ostéoclastes d'origine hématopoïétique, participent au maintien des CSH en quiescence ainsi qu'à l'expression de leur fonctionnalité SP (efflux des drogues). Les niches vasculaires, formées par les cellules endothéliales des nombreux vaisseaux qui irriguent la moelle osseuse, représentent plutôt un site de prolifération/auto-renouvellement et de différenciation des CSH. Récemment, l'existence d'une troisième niche, de type mésenchymateuse péri-vasculaire, a été proposée comme étant le chainon manquant entre les niches endostéales et vasculaires. Enfin, la participation du système neuro-sympathique, des cellules Schwann ainsi que des lymphocytes Treg, a apporté une nouvelle dimension neuro-immune à la régulation par les niches médullaires. Au sein de telles niches, la régulation des CSH fait intervenir des interactions avec les différents types cellulaires (cellules stromales mésenchymateuses, cellules ostéo-compétentes, adipocytes, cellules endothéliales..), des facteurs diffusibles (cytokines, chimiokines..), des molécules de la matrice extracellulaire (MEC) et des éléments environnementaux tels que la concentration en oxygène et en calcium (cf. figure 1).

En dehors de leur rôle crucial dans le maintien de l'homéostasie hématopoïétique, la contribution des niches dans le développement de pathologies dans lesquelles l'hématopoïèse est soit dérégulée, soit délocalisée dans des sites ectopiques, est encore mal comprise. Dans ce contexte, notre équipe étudie le rôle des interactions mutuelles entre les cellules souches et leurs niches, dans la régulation de l'hématopoïèse, chez l'homme, en physiologie et au cours d'hémopathies, néoplasiques ou non, avec un objectif cognitif et thérapeutique (cf Figure 2).

Une meilleure compréhension des interactions entre CSH et leur niches et de leur rôle dans la régulation de l'hématopoïèse servira de base à l'étude des instructions mutuelles entre les cellules souches dans d'autres niches tissulaires/organes. Elle devrait également favoriser le développement de thérapies ciblées sur les altérations du microenvironnement chez les patients atteints de leucémies et de cancers, mais aussi améliorer la prise de greffe/prolifération des cellules souches au cours des processus de régénération/réparation tissulaire.
Projets
Sur la base de notre expertise, nous étendons actuellement notre étude sur le rôle du microenvironnement hématopoïétique dans la régulation des cellules souches hématopoïétiques adultes au développement embryonnaire humain et à des situations pathologiques, néoplasiques ou non. Nous analysons la signature transcriptomique et protéique des cellules souches et étudions le rôle des instructions entre les cellules souches et leurs niches dans maintien/induction de leurs propriétés souches, telles que : quiescence, chimoresistance, prolifération et différenciation. Pour atteindre ces objectifs, nous avons développé de nouvelles technologies permettant de purifier et de caractériser les CSH chimiorésistantes (cellules SP ALDH). Nous avons également développé des modèles in vitro (biomatériaux d'hydroxyapatite ; brevet # WO2013/024096FR) et in vivo (xénogreffe chez la souris immunodéficientes) de niches hématopoïétiques humaines en 3D afin de nous rapprocher le plus possible de la situation in vivo dans la moelle osseuse (cf Figure 3). L'accès aux échantillons biologiques de patients s'appuie sur des réseaux de recherche cliniques développés depuis plusieurs années en France et à l'étranger.
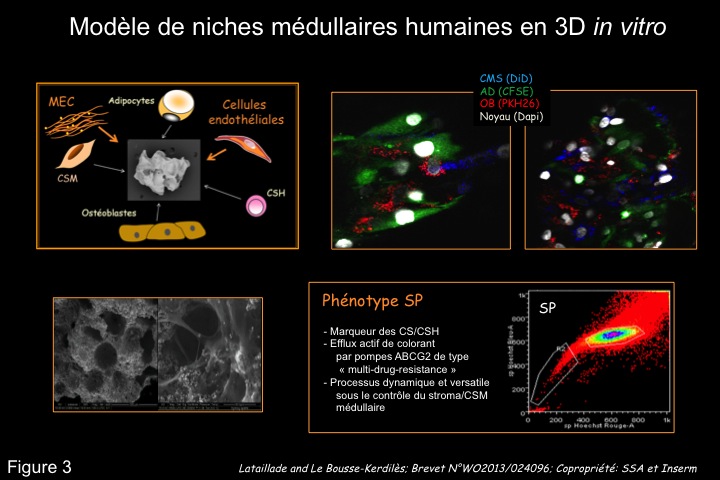
Projet 1: Optimiser nos modèles de niches hématopoïétiques humaines en 3D in vitro et in vivo pour étudier différentes situations pathologiques humaines,
Projet 2: Etendre l'étude du rôle des niches hématopoïétiques dans la régulation de l'hématopoïèse au développement embryonnaire humain,
Projet 3: Comprendre le rôle des niches hématopoïétiques dans la pathogenèse de néoplasie tels que les néoplasmes myéloprolifératifs (NMP) et la leucémie aiguë myéloïde (LAM) ainsi que dans la chimiorésistance des cellules souches leucémiques,
Projet 4: Étudier le rôle des interactions réciproques entre CSH, cellules ostéocompétentes et cellules endothéliales au cours des processus de réparation osseuse et développement ectopique.
Organigramme de l’équipe
| Nom | Position | Institution | Thématique principale |
| LE BOUSSE KERDILES Marie-Caroline | DR2 | INSERM | Cellules souches hématopoïétiques |
| LATAILLADE Jean Jacques | Prof. agrégé Val de Grâce | Ministère de la défense | Cellules stromales mésenchymateuses |
| MALFUSON Jean Valère | Prof. agrégé Val de Grâce | Ministère de la défense | Cellules souches leucémiques |
| ANGINOT Adrienne | CR/CDI | INSERM | Cellules souches hématopoïétiques |
| MARTINAUD Christophe | PH | Ministère de la défense | Cellules souches leucémiques |
| TRIGNOL Aurélie | PH | Ministère de la défense | Cellules souches leucémiques |
| TOROSSIAN Frédéric | Post-Doc | Privé | Niches hématopoïétiques ectopiques |
| AROUCHE Nassim | IE | INSERM | Niches vasculaires |
| GUERTON Bernadette | IE | Privé | Cellules souches hématopoïétiques |
| BOUTIN Laetitia | Tech | Ministère de la défense | Cellules souches leucémiques |
Publications marquantes, Brevets...
2014
- Marjorie Durand, Jean-Marc Collombet, Sophie Frasca, Laurent Begot, Jean-Jacques Lataillade*, Marie-Caroline Le Bousse-Kerdilès* and Xavier Holy*. In vivo hypobaric hypoxia performed during the remodeling process accelerates bone healing in mice. Stem cells Translational Medicine; in revision (* Co-authors)
- Torossian F,Anginot A,Chabanon A, Clay D, Guerton B, Desterke D, Boutin L, Marullo S, Scott M.G.H., Lataillade JJ *and Le Bousse-Kerdilès MC*. CXCR7 participates in CXCL12-induced CD34+ cell cycling through β-arrestin-dependent Akt activation. Blood 2014, 123 (2), 191-202. (* Co-authors)
2013
- Malfuson JV, Boutin L, Clay D, Thépenier C, Desterke C, Torossian F, Guerton B, Anginot A, de Revel T, Lataillade JJ* and Le Bousse-Kerdilès MC*.SP/drug efflux functionality of hematopoietic progenitors is controlled by mesenchymal niche through VLA-4/CD44 axis. Leukemia.2013 Sep 3.doi: 10.1038/leu.2013.256. [Epub ahead of print](* Co-authors)
- Grelier A, Cras A, Balitrand N, Delmau C, Lecourt S, Lepelletier Y, Riesterer H, Freida D, Lataillade JJ, Le Bousse-Kerdilès MC, Cuccini W, de Latour RP, Marolleau JP, Uzan G, Larghero J, Vanneaux V. (2013). Toll-like receptor 3 regulates cord blood-derived endothelial cell function in vitro and in vivo. Angiogenesis. 2013 Jun 8. [Epub ahead of print]
- Blazsek I, Clay D, Leclerc P, Blazsek J, Candelier JJ, Dobo-Nagy C, Khazaal I, Péault B, Uzan G & Le Bousse-Kerdilès MC.Purification and processing of blood-forming tissue units, the haematons, in searching for mammalian stem cell niches; Nature Protocol Exchange 2013. doi:10.1038/protex.2013.006 Published online 10 January 2013;
http://www.nature.com/protocolexchange/protocols/2553
- Frescaline G, Bouderlique T, Mansoor L, Carpentier G, Baroukh B, Sineriz F, Trouillas M, Saffar JL, Courty J, Lataillade JJ, Papy-Garcia D, Albanese P. Glycosaminoglycan mimetic associated to human mesenchymal stem cell-based scaffolds inhibit ectopic bone formation, but induce angiogenesis in vivo. Tissue Eng Part A. 2013 Jul;19(13-14):1641-53.
- Trouillas M, Prat M, Doucet C, Ernou I, Laplace-Builhé C, Blancard PS, Holy X, Lataillade JJ. A new platelet cryoprecipitate glue promoting bone formation after ectopic mesenchymal stromal cell-loaded biomaterial implantation in nude mice. Stem Cell Res Ther. 2013 Jan 4;4(1):1
- Despars G*, Pandruvada SN*, Anginot A*, Domenget C, Jurdic P, Mazzorana M. DAP12 overexpression induces osteopenia and impaired early hematopoiesis. PLoS One. 2013 11;8(6):e65297.
Anginot A, Espeli M, Chasson L, Mancini SJ, Schiff C. Galectin 1 modulates plasma cell homeostasis and regulates the humoral immune response. J Immunol. 2013 Jun 1;190(11):5526-33
2012
- Le Bousse-Kerdilès MC. Primary Myelofibrosis and the "Bad Seeds in Bad Soil" concept. Fibrogenesis& Tissue Repair 2012 5 (Suppl 1):S20; doi:10.1186/1755-1536-5-S1-S20
- Gluckman E and Le Bousse-Kerdilès M.C. Cell therapy for tissue regeneration/repair. Haematopoietic stem cell transplantation.2012 (23); Pp 6432-655.The EBMT Handbook.Forum Service Editore, Genova, Italy.
- E. Busson, C. Thépenier, F. Bolotte and J-J Lataillade. Mesenchymal Stem Cells. Regenerative Medicine and Cell Therapy; J-F Stoltz (Ed.) IOS Press 2012
- M. Alexaline, C. Thépenier and J-J Lataillade. Cell Therapy of Burns. Regenerative Medicine and Cell Therapy; J-F Stoltz (Ed.) IOS Press 2012
- Tamarat R, Lataillade JJ, Bey E, Gourmelon P, Benderitter M. Stem cell therapy: from bench to bedside. Radiat Prot Dosimetry. 2012 Oct;151(4):633-9.
2011
- Desterke C,Bilhou-Nabéra C, Guerton B, Tonetti C, Denis Clay, Olivier Pierre-Louis, Alessandro M Vannucchi, Dominique Bordessoule, Hans Hasselbalch, Vladimir Lazar, William Vainchenker, Annelise Bennaceur-Griscelli, Heinz Gisslinger, Stéphane Giraudier and M.C Le Bousse-Kerdilès. Flt3 Mediated p38-MAPK activation participates in the control of megakaryopoiesis in primary myelofibrosis, Cancer Research. 2011, 71 (8), 2901-2915.
- Sideri A, Neokleous N, Brunet de la Grange P, Guerton B, Le Bousse-Kerdilès MC, Uzan G,Peste-Tsilimidos C, Gluckman E. An overview of the progress on double umbilical cord blood transplantation.Haematologica. 2011, 96(8); 1213-1220.
- Giuliani M, Fleury M, Vernochet A, Ketroussi F, Clay D, Azzarone B, Lataillade JJ, Durrbach A. Long-lasting inhibitory effects of fetal liver mesenchymal stem cells on T-lymphocyte proliferation. PLoS One. 2011;6(5):e19988.
- Martinaud C, Thépenier C, Trouillas M, Peltzer J, Uzan G, Le Bousse-Kerdilès M.C, Prat M and Lataillade JJ; Les cellules souches mésenchymateuses: des cellules pour la médecine régénérative du futur ? RFL, Dec 2010; Pp 47-61. Elsevier Masson Editor.
2010
- Baran-Marszak F, Magdoud H, Desterke C, Alvarado A, Roger C, Harel S, Mazoyer E, Cassinat B, Chevret S, Tonetti C, Giraudier S, Fenaux P, Cymbalista F, Varin-Blank N, Le Bousse-Kerdilès MC, Kiladjian JJ and Velasquez L. Expression level and differential JAK2V617-binding of the adaptor protein Lnk regulates JAK2-mediated signals in myeloproliferative disorders. Blood. 2010 Dec 23;116(26):5961-71.
- Vanneaux V, El-Ayoubi F, Delmau C, Driancourt C, Lecourt S, Grelier A, CrasA,Cuccuini W, Soulier J, Lataillade JJ, Le Bousse-Kerdilès MC, Oury JF, Sibony O, Marolleau JP, Benbunan M, Uzan G, And Larghero J. In Vitro And In Vivo Analysis Of Endothelial Progenitor Cells From Cryopreserved Umbilical Cord Blood: Are We Ready For Clinical Application. Cell Transplant. 2010;19 (9):1143-55.
- Tarte K, Gaillard J, Lataillade JJ, Fouillard L, Becker M, Mossafa H, Tchirkov A, Rouard H, Henry C, Splingard M, Dulong J, Monnier D, Gourmelon P, Gorin NC, Sensebé L; Société Française de Greffe de Moelle et Thérapie Cellulaire. Clinical-grade production of human mesenchymal stromal cells: occurrence of aneuploidy without transformation. Blood. 2010 Feb 25;115(8):1549-53.
- Lataillade JJ, Brunet De La Grange P, Uzan G And Le Bousse-Kerdilès MC. Are Stem Cells As old As Their Niches? The Quest For Internal Life. Médecine Sciences, 2010; 26 (6-7): 22-25
2009
- Villeneuve J, Block A, Le Bousse-Kerdilès MC, Lepreux S, Nurden P, Ripoche J, And Nurden AT. Tissue Inhibitors Of Matrix Metalloproteinases In Platelets And Megakaryocytes: A Novel Organization For These Secreted Proteins. Experimental.Hematol. 2009; 37 (7):849-856.
- Goldman O, Feraud O, Boyer-Di Ponio J, Driancourt C, Clay D, Le Bousse-Kerdilès M.C., Bennaceur-Griscelli A And Uzan G. A Boost Of BMP4 Accelerates The Commitment Of Human Embryonic Stem Cells Into The Endothelial Lineage. Stem Cells 2009; 27 (8 August): 1750 -1759.
- Pierre-Louis O, Clay D, Brunet De La Grange P, Blazsek I, Desterke C, Guerton B, Blondeau C, Malfuson JV, Prat M, Bennaceur-Griscelli A, Lataillade JJ And Le Bousse-Kerdilès MC. Dual SP/ALDH Functionalities Refine The Human Hematopoietic Lin-CD34+CD38- Stem/Progenitor Cell Compartment. Stem Cells. 2009 Oct;27(10):2552-62.
2008
- Giuliani M, Giron-Michel J, Negrini S, Vacca P, Durali D, Caignard A, Le Bousse-Kerdilès MC,Chouaib S, Devocelle A, Bahri R, Durrbach A, Taoufik Y, Ferrini S, Croce M, MingariMc, Moretta L, Azzarone B. Generation Of A Novel Regulatory NK Cell Subset From Peripheral Blood CD34+ Progenitors Promoted By Membrane-Bound IL-15. Plos ONE, May 2008, 3, 5, E2241.
- Bogani C, Ponziani V, Guglielmelli P, Desterke C, Rosti V, Bosi A, Le Bousse- Kerdilès MC, Barosi G And Vannucchi Am, For The Myeloproliferative Disorders Research Consortium-MPD-RC. HypermethylationOf CXCR4 Promoter In CD34+ Cells From Patients With Primary Myelofibrosis. Stem Cells 2008 Aug;26(8):1920-30.
- Chaligné R, Tonetti C, Besancenot R, Roy L, Mossuz P, Kiladjian Jj, Socié G, Bordessoule D, Le Bousse-Kerdilès MC, Vainchenker W And Giraudier S. MPL Exon 10 Mutations In Primitive Myelofibrosis: MPLW515 Mutations Promote G1/S Phase Transition. Leukemia 2008 Aug;22(8):1557-66.
- Lataillade JJ, Pierre-Louis O, Hasselbalch HC, Uzan G, Jasmin C, Martyre MC, Le Bousse-Kerdilès MC. Does Primary Myelofibrosis Involve A Defective Stem Cell Niche? From Concept To Evidence. Blood. 2008 Oct 15;112(8):3026-35.
- Chabanon A, Desterke C, Rodenburger E, Clay D, Guerton B, Boutin L, Bennaceur-Griscelli A, Pierre-Louis O, Uzan G, Abecassis L, Bourgeade MF, Lataillade JJ And Le Bousse-Kerdilès MC. A Cross-Talk between SDF-1 And TGF-Β Controls The Quiescence/Cycling Switch Of CD34+ Progenitors Through Foxo3 And mTOR. Stem Cells, 2008 Dec;26(12):3150-61.
- Le Bousse-Kerdilès MC, Martyré MC And Samson M. Cellular And Molecular Mechanisms Underlying Bone Marrow And Liver Fibrosis.Eur Cytokine Netw. 2008 Jun;19(2):69-80.
- Le Bousse-Kerdilès MC, Martyré Mc & Le Groupe D'étude Sur Les Myélofibroses (GEM). Physiopathologie De La Myélofibrose Primitive: Passé, Présent et Avenir! Hématologie FMC, 2008, 4, 33-40.
Dupriez B., Demory J.-L., Le Bousse-Kerdilès M.C., Giraudier S., Bilhou-Nabera C., Abgrall J.-F., Rey J. Myélofibrose Primitive. EMC(Elsevier Masson SAS, Paris), Hématologie, 13-011-B-60, 2008.
