Organites, ubiquitinylation et signalisation
Thèmatique de recherche
Nos projets de recherche actuels se focalisent désormais principalement sur le rôle de l'ubiquitination non dégradative (ubiquitination dite en K63), mais également sur les dé-ubiquitinations, dans les voies de signalisation conduisant notamment à l'activation des facteurs de transcription NF-?B ou bien IRF3. De plus, nous nous intéressons au rôle d'organites intracellulaires comme le réticulum endoplasmique, les mitochondries ou l'Appareil de Golgi dans les voies de signalisation conduisant à l'activation de ces facteurs de transcription.

projet 1
Implication du réticulum endoplasmique dans l'intégration du signal externe conduisant à l'activation de NF-κB
L'immunité innée et adaptative engagent la signalisation conduisant à l'activation de NF-κB par l'ubiquitination sélective d'adaptateurs spécifiques du contexte. Nous avons observé que ces Transmetteurs Ubiquitinylés Conduisant à l'Activation de NF-κB (que l'on appellera ici les TUCAN), c'est à dire RIP1, Bcl-10, TRAF2, RIP2 ou bien IRAK1 s'accumulent dans la fraction contenant les membranes lourdes (mitochondries, réticulum endoplasmique, golgi, lysosomes etc) et plus particulièrement au niveau du côté cytosolique de la membrane du réticulum endoplasmique (RE) suite à la stimulation respectivement du TNFR, TCR, CD40, Nod2, TLR4, TLR3 et RLR (Alexia et al., 2013).
Il est intéressant de noter que dans un système in vitro, nous avons observé que la fraction de membranes lourdes (qui, rappelons-le, contient notamment le RE) de cellules activées est capable d'induire la phosphorylation de IκBα, un des inhibiteurs de NF-κB. Ceci confirme que le RE, via l'accumulation des TUCAN, contient alors l'information nécessaire pour permettre l'activation de NF-κB.
Par spectrométrie de masse, nous avons identifié la méthadérine (MTDH), une protéine ancrée au RE, comme un partenaire des TUCAN. L'extinction de MTDH diminue sélectivement l'activation de NF-κB suite à différents stimuli, notamment le TNFα et de fait inhibe la production de cytokine ou bien l'activation des lymphocytes (Alexia et al., 2013).
Bien que les TUCAN sont normalement ubiquitinylés suite aux diverses stimulations, nous avons observé que moins de TUCAN s'accumulaient au RE dans les cellules déficientes en MTDH, suggérant que la MTDH permet l'accumulation des TUCAN au RE, ce qui propage ultérieurement la signalisation NF-κB (Alexia et al., 2013).
Nos résultats impliquent donc que la MTDH intègre les signaux en amont pour les convertir en réponses biologiques à travers l'axe IKK/NF-κB (Figure 1) (Alexia et al., 2013).
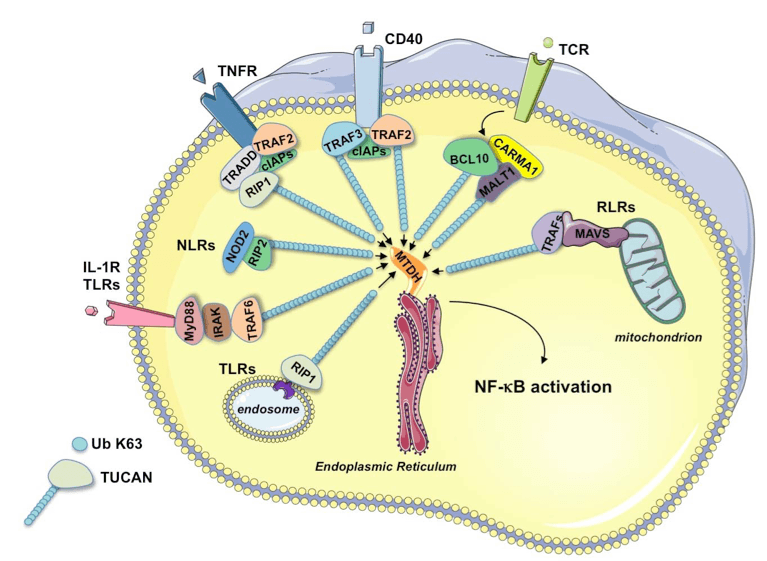
Figure 1. La MTDH fonctionne comme une clef de voute pour reconnaître les TUCAN et les cristalliser à la surface du RE
A l'aide de protéines recombinantes, nous avons montré que la MTDH se lie essentiellement aux chaines d'ubiquitine K63 (Alexia et al., 2013). Nous pensons ainsi que la MTDH pourrait agir comme un « senseur » des protéines ubiquitinylées. La petite quantité d'IKK et d'IκBα observée dans les membranes lourdes suggère que le « methadherinosome » constitue une étape importante dans le processus de l'activation de NF-κB.
D'autres études sont nécessaires pour comprendre précisément comment les signalosomes émanant des immuno-récepteurs maturent puis transitent via le RE pour finalement s'associer et activer NF-κB via le complex IKK. Nous disposons désormais de cellules issues de souris déficientes en MTDH pour répondre à ces questions..
Une question passionnante est quel peut être le rôle du RE dans la transduction du signal NF-κB via la MTDH ancrée à cet organite. Il est en effet fort probable que si la MTDH n'est pas associée au RE, alors la signalisation sera affectée. Nous sommes en train de vérifier cela. De la même manière, MAVS, protéine essentielle à la transduction du signal après activation des RLRs, est ancrée à la membrane mitochondriale externe et doit être absolument localisée à cet endroit pour pouvoir exercer sa fonction, sans que l'on ne sache pour autant encore quel est vraiment le rôle de la mitochondrie. De plus, nous essayons de comprendre si l'expression de la MTDH est régulée, notamment par les nombreuses E3 ubiquitine ligases associée au RE.
projet 2
Caractérisation de DUBs impliquées dans la régulation négative de la signalisation après reconnaissance des ARNs viraux
Tout comme la phosphorylation, l'ubiquitination est un phénomène réversible par l'intermédiaire des dé-ubiquitinases (DUBs) qui sont des protéases. Il existe une centaine de DUBs dans le génome humain mais peu ont été caractérisées pour le moment. Dans le cas d'ubiquitination K63, dont le rôle est la transduction du signal grâce au recrutement de complexes kinasiques comme le complexe IKK, la fonction de certaines DUBs va être d'inhiber la transduction du signal en clivant ces chaines d'ubiquitines.
Nous disposons au laboratoire d'une banque de siRNAs dirigée contre les différentes DUBs (à nouveau 2 siRNAs par cible) et nous avons utilisé cette banque pour réaliser un criblage en essais luciférase de cellules HEK293T exprimant de façon stable le Toll-like Recepteur 3 (TLR3) et traitées au poly(I :C), un analogue des ARNs double brins viraux qui sont les ligands du TLR3. La stimulation du TLR3 conduit non seulement à la production de cytokines pro-inflammatoires via l'activation de NF-κB mais également à la production d'IFN de type I via le facteur de transcription IRF3 (Figure 2).

Figure 2. La signalisation du TLR3 et l'implication de l'ubiquitination K63
Le TLR3 présent dans les endosomes se lie à son ligand, l'ARN double brin. L'adaptateur TRIF se fixe au domaine cytoplasmique du TLR3 ce qui permet alors le recrutement de TRAF6, RIP1 et TRAF3. L'ubiquitination K63 de TRAF6 et RIP1 permet aux complexes TABs/TAK1 et IKK d'être recrutés, ce dernier étant activé par la phosphorylation d'IKKβ par TAK1. L'ubiquitination K63 de TRAF3 quant à elle permet le recrutement d'un autre complexe comprenant notamment NEMO et la kinase TBK1 laquelle phosphoryle IRF3 ce qui conduit à son activation et dimérisation pour produire les IFNs de type I.
L'activation de NF-κB ou d'IRF3 peut être mesurée par essais luciférase si bien que ces essais sont utilisés pour identifier d'éventuelles DUBs régulant négativement les voies qui conduisent à l'activation de NF-κB et/ou d'IRF3. De fait, nous nous intéressons aux protéines dont l'extinction à l'aide des siRNAs augmente l'activité NF-κB ou bien celle du promoteur IFNβ. Il existe déjà trois DUBs connus comme régulant négativement la voie NF-κB, il s'agit d'A20, CYLD et Cezanne alors que DUBA pourrait réguler négativement la voie IRF3 même si cela n'a jamais été confirmé par un modèle animal. De fait, nous nous focalisons principalement dans notre crible sur les DUBs qui apparaissent comme régulant négativement la voie IRF3. Nous avons quelques protéines candidates et nous sommes en train d'étudier leur implication dans la régulation de la signalisation du TLR3 ainsi que dans la voie des RIG-I-like Récepteurs (RLR).
La caractérisation d'une telle DUB serait d'une grande importance dans le domaine de l'immunité innée car l'élaboration d'inhibiteurs de cette protéase pourrait avoir un grand intérêt en vue de nouvelles thérapies anti-virales.
Projet 3
Implication de l'Appareil de Golgi et de l'ubiquitination dans le trafic et l'activation de TBK1
Outre son auto-phosphorylation, de récents travaux ont démontré l'importance de la polyubiquitination de la kinase TBK1 pour permettre son activation afin d'induire la production d'IFN de type I. Nos récents résultats montrant l'implication du RE comme plateforme d'accumulation des TUCAN, nous a alors conduit à examiner si on observait également une accumulation de la forme ubiquitinylée de TBK1 au niveau des membranes lourdes après activation des RLRs ou du TLR3. Ainsi, de manière surprenante, nous avons observé, après lyse mécanique des cellules et centrifugations différentielles, une accumulation de TBK1 polyubiquitinylée et phosphorylée au niveau de la fraction membranaire enrichie en Appareil de Golgi après activation des RLRs en infectant des MEFs par le virus de Sendai. Nous avons fait les mêmes observations après infection de cellules HeLa mais également et c'est intéressant de le signaler, après activation du TLR3.
Une analyse en immunofluorescence montre que bien que la localisation TBK1 n'est pas modifiée après activation des RLRs, la forme active (p-TBK1) semble s'accumuler au niveau de l'Appareil de Golgi et non aux mitochondries.
En conditions physiologiques, lors de l'infection par le virus de Sendai, la localisation de TBK1 ne semble pas être affectée. Nous nous sommes demandés ce qu'il en était alors suite à une activation exacerbée des RLRs, par exemple après transfection de poly (I:C). En effet, dans le cytosol, le poly (I:C) est reconnu soit par MDA-5 ou RIG-I selon son poids moléculaire. De façon intéressante, la transfection de poly (I :C) conduit alors à une agrégation de TBK1 associée à la translocation nucléaire d'IRF3 et cette agrégation de TBK1 se fait au niveau de l'Appareil de Golgi, où l'on retrouve effectivement la forme active de TBK1. Même si il s'agit d'un modèle non physiologique où la stimulation des RLRs est exacerbée, il semble qu'après la stimulation des RLRs (mais également du TLR3), TBK1 se relocalise au niveau de l'Appareil de Golgi où va alors se produire l'activation de TBK1.
Une étude très récente a montré un rôle essentiel de l'ubiquitination des lysines 30 et 401 de TBK1 pour une activation efficace de cette kinase. Comme nous observons une accumulation de TBK1 ubiquitinylée et phosphorylée au niveau de l'Appareil de Golgi, nous pensons alors que l'ubiquitination de TBK1 permet son adressage au Golgi où elle peut alors s'activer par trans-autophosphorylation. Pour vérifier cela, nous allons très bientôt reconstituer des MEFs TBK1 -/- que l'on a obtenu du laboratoire du Dr. K. Fitzgerald (University of Massachusetts Medical School, Worcester, USA) avec le mutant TBK1K30-401A ainsi qu'avec TBK1 WT comme control. Après transfection du poly (I :C), nous regarderons alors si la relocalisation de TBK1 au Golgi est inhibée dans les MEFs TBK1 -/- reconstitués avec le mutant de TBK1, par rapport aux cellules exprimant le TBK1 WT. Cette expérience confirmerait alors le rôle de l'ubiquitination de TBK1 dans le trafic de TBK1 au cours de son activation.
Une autre étude très récente a proposé que les chaines d'ubiquitines associées à TBK1 étaient reconnu par des « senseurs » afin de permettre le rapprochement des molécules de TBK1 pour la trans-autophosphorylation. Un tel senseur se doit par conséquent d'avoir des UBD (Ubiquitin Binding Domains) et selon nos observations, devrait être également localisé au niveau de l'Appareil de Golgi. Nous sommes alors à la recherche d'un tel senseur et nous orientons nos recherches sur l'optineurine qui semble être un bon candidat (Figure 3).
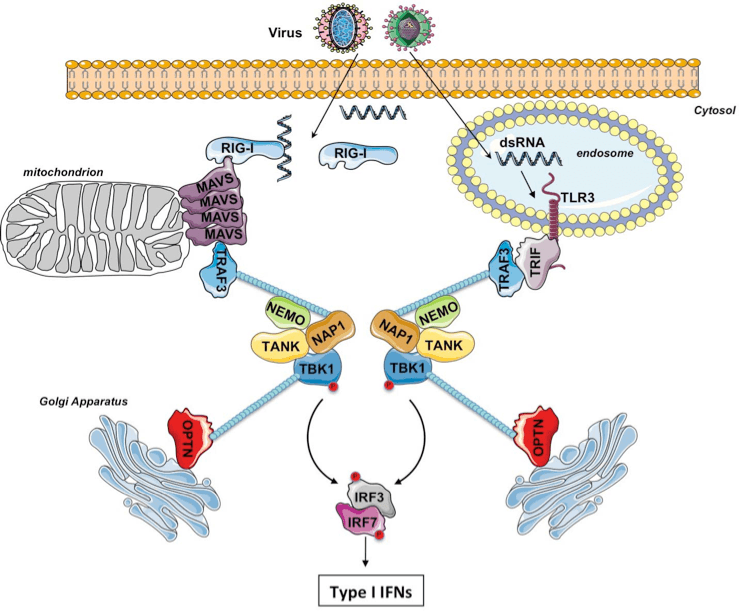
Figure 3. Proposition de modèle impliquant l'Appareil de Golgi dans l'activation de TBK1.
L'ubiquitination de TRAF3 après stimulation des RLRs ou du TLR3 permet le recrutement du complexe comprenant NEMO/TBK1, laquelle est également ubiquitinylée et les chaines d'ubiquitine liées à cette kinase sont alors reconnu par un senseur comme l'Optineurine (OPTN) localisée à l'appareil de Golgi pour une activation optimale de TBK1. Après trans-autophosphorylation, TBK1 phosphoryle IRF3 afin de permettre la production d'IFNs de type I.
Organigramme de l’équipe
| Nom | Position | Institution | Thématique principale |
| ARNOULT damien | CR1 | CNRS | |
| SILVA DA COSTA Leandro | Post-doc | ||
| ZEMIRLI Naima | Post-doc | ||
| POURCELOT Marie | Doctorante | Paris XI | |
| RODERS Nathalie | Doctorante | Paris XI | |
| OUTLIOUA Ahmed | Doctorante | Univ. Casablanca | |
| GILBERT Sophie | Etudiante M2 | Paris XI | |
| LOYANT Roxane | Etudiante BTS | ||
| PORTIER | Technicien | Paris XI |
Publications marquantes, Brevets...
2014
-Zemirli N, Pourcelot M, Dogan N, Vazquez A, Arnoult D. The E3 ubiquitin ligase RNF121 is a positive regulator of NF-?B activation. Cell Commun Signal. 2014 Nov 12;12(1):72. [Epub ahead of print]
-Pourcelot M, Arnoult D. Mitochondrial dynamics and the innate antiviral immune response. FEBS J. 2014 Sep;281(17):3791-802.
-Soares F, Tattoli I, Rahman MA, Robertson SJ, Belcheva A, Liu D, Streutker C, Winer S, Winer DA, Martin A, Philpott DJ, Arnoult D, Girardin SE. The mitochondrial protein NLRX1 controls the balance between extrinsic and intrinsic apoptosis. J Biol Chem. 2014 Jul 11;289(28):19317-30
-Zemirli N, Pourcelot M, Ambroise G, Hatchi E, Vazquez A, Arnoult D. Mitochondrial hyperfusion promotes NF-κB activation via the mitochondrial E3 ligase MULAN. FEBS J. 2014 Jul;281(14):3095-112
2013
-Alexia C, Poalas K, Carvalho G, Zemirli N, Dwyer J, Dubois S, Hatchi E, Cordeiro N, Smith SS, Castanier C, Le Guelte A, Wan L, Kang Y, Vazquez A, Gavard J, Arnoult D, Bidere N. The endoplasmic reticulum acts as a platform for ubiquitylated components of NF-kB signaling. Sci Signal. 2013 Sep 3 ;6(291).
-Soares F, Tattoli I, Arnoult D, Philpott DJ, Girardin SE. NLRX1 does not inhibit MAVS-dependent antiviral signaling. Innate Immun. 2013;19(4):438-48.
2012
-Zemirli N, Arnoult D. Mitochondrial anti-viral immunity. Int J Biochem Cell Biol. 2012 Sep;44(9):1473-6.
-Castanier C, Zemirli N, Portier A, Garcin D, Bidere N, Vazquez A, Arnoult D. MAVS ubiquitination by the E3 ligase TRIM25 and degradation by the proteasome is involved in type I Interferon production after activation of the antiviral RIG-I-Like receptors. BMC Biol. 2012 May 24;10(1):44.
2011
-Arnoult D, Soares F, Tattoli I, Girardin SE. Mitochondria in innate immunity. EMBO Rep. 2011 Sep 1;12(9):901-10.
-Edlich F, Banerjee S, Suzuki M, Cleland MM, Arnoult D, Wang C, Neutzner A, Tjandra N, Youle RJ. Bcl-x(L) Retrotranslocates Bax from the Mitochondria into the Cytosol. Cell. 2011 Apr 1;145(1):104-16.
-Castanier C, Arnoult D. Mitochondrial localization of viral proteins as a means to subvert host defense. Biochim Biophys Acta. 2011 Apr;1813(4):575-83.
2010
-Castanier C, Arnoult D. Mitochondrial dynamics during apoptosis. Med Sci (Paris). 2010 Oct;26(10):830-5.
-Chang CR, Manlandro CM, Arnoult D, Stadler J, Posey AE, Hill RB, Blackstone C. A lethal de novo mutation in the middle domain of the dynamin-related GTPase Drp1 impairs higher order assembly and mitochondrial division. J Biol Chem. 2010 Oct 15;285(42):32494-503.
-Castanier C, Garcin D, Vazquez A, Arnoult D. Mitochondrial dynamics regulate the RIG-I-like receptor antiviral pathway. EMBO Rep. 2010 Feb;11(2):133-8.
2009
-Arnoult D, Soares F, Tattoli I, Castanier C, Philpott DJ, Girardin SE. An N-terminal addressing sequence targets NLRX1 to the mitochondrial matrix. J Cell Sci. 2009 Sep 1;122(Pt 17):3161-8.
-Figueroa-Romero C, Iñiguez-Lluh JA, Stadler J, Chang CR, Arnoult D, Keller PJ, Hong Y, Blackstone C, Feldman EL. SUMOylation of the mitochondrial fission protein Drp1 occurs at multiple nonconsensus sites within the B domain and is linked to its activity cycle. FASEB J. 2009 Nov;23(11):3917-27
-Arnoult D, Carneiro L, Tattoli I, Girardin SE. The role of mitochondria in cellular defense against microbial infection. Semin Immunol. 2009 Aug;21(4):223-32.
-Bidère N, Ngo VN, Lee J, Collins C, Zheng L, Wan F, Davis RE, Lenz G, Anderson DE, Arnoult D, Vazquez A, Sakai K, Zhang J, Meng Z, Veenstra TD, Staudt LM, Lenardo MJ. Casein kinase 1alpha governs antigen-receptor-induced NF-kappaB activation and human lymphoma cell survival. Nature. 2009 Mar 5;458(7234):92-6.